Phản ứng C6H6 + H2 → C6H12
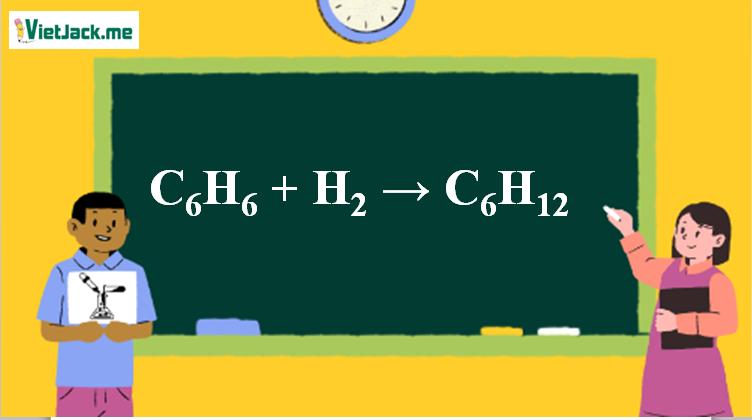
1. Phương trình phản ứng Benzen cộng H2
C6H6 + 3H2 C6H12
2. Điều kiện để C6H6 ra C6H12
Benzen phản ứng cộng vs H2 khi sử dụng Niken làm chất xúc tác tạo ra xiclohexan.
3. Bản chất của C6H6 (Benzen) trong phản ứng
Trong điều kiện thích hợp C6H6 có phản ứng cộng với một số chất như H2, Cl2,…
4. Tính chất của Benzen
4.1. Tính chất vật lý Benzen
Bezen là chất lỏng, không màu, có mùi thơm đặc trưng nhẹ hơn nước và không tan trong nước.
4.2. Tính chất hóa học Benzen
Tính chất hóa học nổi bật của benzen là phản ứng thế, phản ứng cộng và phản ứng oxi hóa. Và đây cũng là 3 tính chất hóa học phổ biến của các chất thuộc đồng đẳng benzen hoặc các hiđrocacbon thơm.
Phản ứng thế
C6H6+ Br2 → C6H5Br + HBr (Fe, to)
C6H6 + HNO3 → C6H5NO2 + H2O (H2SO4 đặc, to)
Phản ứng cộng
C6H6 + 3H2 → xiclohexan (Ni, to)
C6H6 + 3Cl2 → C6H6Cl6 (as) (hexacloran hay 666 hay 1,2,3,4,5,6 - hexacloxiclohexan)
Phản ứng oxi hóa
Benzen không làm mất màu dung dịch KMnO4.
Oxi hóa hoàn toàn:
C6H6 + 7,5O2 → 6CO2+ 3H2O (to)
4.3. Điều chế benzen
Từ axetilen:
3C2H2 → C6H6 (C, 600oC)
Tách H2 từ xiclohexan:
C6H12→ C6H6 + 3H2 (to, xt)
4.4. Ứng dụng của Benzen
Trong ngành công nghiệp, benzen được dùng trong một số ngành công nghiệp hóa hữu cơ. Nó được sử dụng chủ yếu làm dung môi trong công nghiệp hóa chất và dược phẩm. Nó là nguyên liệu ban đầu và chất trung gian điều chế ra những hóa chất khác, đáng kể đến là cumene, cyclohexane, etylbenzen (các ankylbenzen khác) và nitrobenzene.
Benzen được dùng để điều chế phenol và anilin được sử dụng trong thuốc nhuộm và trong dodecylbenzene được sử dụng cho chất tẩy rửa. Bên cạnh đó, chúng còn được sử dụng để tổng hợp monome trong sản xuất cao su, chất bôi trơn, polyme dùng cho nhựa, chất tẩy rửa, chất nổ, thuốc trừ sâu và sợi.
Benzen cũng là dung môi hòa tan các chất như dầu mỡ, cao su, vecni. Vì vậy, nó được ứng dụng để để tẩy dầu mỡ cho sợi, vải, len, dạ, giặt khô, tấm kim loại, dụng cụ.
Ngoài ra benzen còn là một thành phần trong xăng để tăng chỉ số octan.
5. Câu hỏi vận dụng
Câu 1. Dãy đồng đẳng của benzen (gồm benzen và ankylbenzen) có công thức chung là:
A. CnH2n+6(n ≥ 6).
B. CnH2n-6 (n ≥ 3).
C. CnH2n-8 (n ≥ 8).
D. CnH2n-6 (n ≥ 6).
Lời giải:
Đáp án: D
Giải thích:
Câu 2. Hoạt tính sinh học của benzen, toluen là
A. Gây ảnh hưởng tốt cho sức khỏe
B. Không gây hại cho sức khỏe
C. Tùy thuộc vào nhiệt độ có thể gây hại hoặc không gây hại
D. Gây hại cho sức khỏe
Lời giải:
Đáp án: D
Giải thích:
Câu 3. Để phân biệt benzen, toluen, stiren ta chỉ dùng 1 thuốc thử duy nhất là
A. dung dịch brom.
B. Br2 (xt Fe).
C. dung dịch Br2 hoặc dung dịch KMnO4.
D. dung dịch KMnO4.
Lời giải:
Đáp án: D
Giải thích:
Không dùng được Br2 dung dịch vì cả benzen và toluen đều không phản ứng.
Không dùng được Br2 khan (xt Fe) vì benzen và toluen đều cho hiện tượng giống nhau.
Có thể dùng dung dịch KMnO4 vì:
+ C6H6 không làm mất màu
+ Stiren làm mất màu KMnO4 ở nhiệt độ thường
3C6H5CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + 10MnO2+ KOH + 4H2O
+ C6H5CH3 làm mất màu KMnO4 khi đun nóng
C6H5CH3 + 2KMnO4 → C6H5COOK + KOH + 2MnO2 + H2O
Câu 4. Nhận xét nào sau đây đúng?
A. Benzen và đồng đẳng của benzen chỉ có khả năng tham gia phản ứng cộng.
B. Benzen và đồng đẳng của benzen chỉ có khả năng tham gia phản ứng thế.
C. Benzen và đồng đẳng của benzen vừa có khả năng tham gia phản ứng cộng, vừa có khả năng tham gia phản ứng thế.
D. Benzen và đồng đẳng của benzen không có khả năng tham gia phản ứng cộng và phản ứng thế.
Lời giải:
Đáp án: B
Xem thêm các phương trình phản ứng hóa học khác:
C6H6 + Br2 → C6H5Br + HBr
C6H6 + Cl2 → C6H5Cl + HCl
CH≡CH → CH2=CH-C≡CH
C2H2 + H2 → C2H6
C2H2 + Br2 → C2H2Br4


